Nervenzellen lassen andere „mithören“
Studie der Uni Bonn: Die Signalübertragung im Gehirn erfolgt je nach Situation mal mehr, mal weniger exklusiv
Wie viele „Mithörer“ eine Nervenzelle im Gehirn hat, wird streng reguliert. Das zeigt eine internationale Studie unter Federführung des University College London und der Universitäten Bonn, Bordeaux und Milton Keynes (England). In der Umgebung lernender Neuronen werden demnach bestimmte Prozesse in Gang gesetzt, durch die die Signalübertragung weniger exklusiv wird. Die Ergebnisse sind nun in der Zeitschrift Neuron erschienen.
Wer einem Bekannten in einer belebten Umgebung ein Geheimnis mitteilen möchte, schirmt das Gespräch oft mit der Hand vor etwaigen Lauschern ab. Auch Nervenzellen im Gehirn kommunizieren hinter vorgehaltener Hand miteinander. Wie stark dieser Schutz ist, wird aber je nach Situation streng reguliert. In diese Richtung deuten zumindest die Ergebnisse, die das internationale Forscherteam nun vorgestellt hat.
Die Informationsübertragung zwischen Neuronen erfolgt meist auf chemischem Wege: Auf ein elektrisches Signal hin schüttet die „Sender-Zelle“ einen sogenannten Neurotransmitter aus; oft handelt es sich dabei um Glutamat-Moleküle. Diese wandern durch den synaptischen Spalt zur Empfänger-Zelle. Dort docken sie an bestimmte Rezeptoren an und erzeugen dadurch im Empfänger-Neuron eine elektrische Reaktion.
Doch die Nervenzellen im Gehirn sind sehr dicht gepackt. Es besteht also die Gefahr, dass die Moleküle nicht nur das Neuron erreichen, für das sie bestimmt sind, sondern auch andere Neuronen in der Nachbarschaft reizen. Hier kommt die „vorgehaltene Hand“ ins Spiel: Spezialisierte Zellen im Gehirn, die Astrozyten, nehmen nämlich das ausgeschüttete Glutamat rasch wieder auf. Auf diesem Wege schirmen sie die Kommunikation gewissermaßen ab. „Dazu entsenden sie Fortsätze in die Nähe von Synapsen, die sogenannten perisynaptischen Astrozytenfortsätze oder PAPs“, erklärt Prof. Dr. Christian Henneberger vom Institut für zelluläre Neurowissenschaften der Universität Bonn.
Molekulare Glutamat-Sauger
PAPs verfügen über spezialisierte Transporter, die wie kleine Staubsauger das Glutamat um die Synapsen entfernen. Wie effektiv dieser Mechanismus funktioniert, wird aber augenscheinlich streng reguliert: Die Wissenschaftler lösten durch eine mehrfach wiederholte elektrische Reizung eine Art „zelluläres Lernen“ aus. Das sorgt dafür, dass die Empfängerzelle langfristig stärker auf die Signale der Senderzelle anspricht. Experten sprechen auch von „long-term potentiation“ (LTP).
„Wir konnten nun zeigen, dass sich die PAPs bei diesem Lernprozess zurückziehen“, erklärt Prof. Dr. Dmitri Rusakov vom Institute of Neurology am University College London. „So steigt die Wahrscheinlichkeit, dass benachbarte Zellen ebenfalls durch die Glutamat-Ausschüttung angeregt werden.“ Die Signalübertragung wird also weniger exklusiv – ein Prozess, der auch andere interessante Beobachtungen erklären könnte, deren Ursache bislang unklar war: LTP kann zum Beispiel auch nahe Verbindungen zwischen anderen Nervenzellen beeinflussen. „Möglicherweise ist das eine wichtige Voraussetzung für das Lernen weiterer Inhalte“, vermutet Henneberger.
Große Synapsen sind weniger diskret
An manchen Synapsen scheint die Kommunikation zudem per se weniger diskret zu sein als an anderen. Das konnte Henneberger zusammen mit seinem Mitarbeiter Dr. Michel Herde und anderen Wissenschaftlern in einer vor wenigen Tagen in „Cell Reports“ erschienenen Studie zeigen. Die Senderzelle schüttet ihr Glutamat oft in der Nähe bestimmter Strukturen in den synaptischen Spalt aus, der sogenannten Spines. Das sind winzige Fortsätze der nachgeschalteten Nervenzelle. Die PAPs umkleiden diese Spines oft regelrecht fast wie eine Art Handschuh. Je größer ein Spine ist, desto lückenhafter ist diese Umkleidung jedoch und desto mehr Glutamat kann entkommen. „In der Nachbarschaft großer und entsprechend starker Synapsen kommt es daher vermutlich häufiger zur Erregung weiterer Nervenzellen“, sagt Herde. Mit anderen Worten: Nervenzellen mit starken synaptischen Verbindungen sprechen selten hinter vorgehaltener Hand.
Publikationen:
Christian Henneberger, Lucie Bard, Aude Panatier, James P. Reynolds, Olga Kopach, Nikolay I. Medvedev, Daniel Minge, Michel K. Herde, Stefanie Anders, Igor Kraev, Janosch P. Heller, Sylvain Rama, Kaiyu Zheng, Thomas P. Jensen, Inmaculada Sanchez-Romero, Colin Jackson, Harald Janovjak, Ole Petter Ottersen, Erlend Arnulf Nagelhus, Stephane H.R. Oliet, Michael G. Stewart, U. Valentin Nägerl und Dmitri A. Rusakov: LTP induction boosts glutamate spillover by driving withdrawal of perisynaptic astroglia; Neuron; DOI: https://doi.org/10.1016/j.neuron.2020.08.030
Michel K. Herde, Kirsten Bohmbach, Cátia Domingos, Natascha Vana, Joanna A. Komorowska-Müller, Stefan Passlick, Inna Schwarz, Colin J. Jackson, Dirk Dietrich, Martin K. Schwarz und Christian Henneberger: Local efficacy of glutamate uptake decreases with synapse size; Cell Reports; DOI: https://doi.org/10.1016/j.celrep.2020.108182
Kontakt:
Prof. Dr. Christian Henneberger
Institut für zelluläre Neurowissenschaften der Universität Bonn
Tel. 0228/287-16304
E-Mail: christian.henneberger@uni-bonn.de
Bilder:
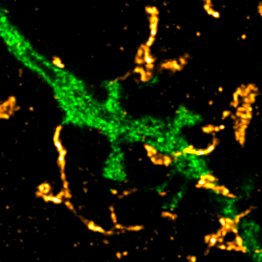
Einzelnes Fragment eines Neurons in grün und die in der Mitteilung erwähnten Astrozytenfortsätze in gelb.
Bildnachweis: © Michel Herde
https://cams.ukb.uni-bonn.de/presse/pm-213-2020/images/Spines-with-astrocyte-GLT1.jpg
Bild oben:
Am Messplatz für kombinierte Elektrophysiologie und Fluoreszenzmikroskopie: Dr. Michel Herde (links) und Prof. Dr. Christian Henneberger im Institut für zelluläre Neurowissenschaften der Universität Bonn.
Bildnachweis: © Rolf Müller/UKB
https://cams.ukb.uni-bonn.de/presse/pm-213-2020/images/Henneberger-Mueller-477-original.jpg