Neue Erkenntnisse zur Bildung der ATP-Synthase erlangt
Forschende am Universitätsklinikum Bonn entdecken eine neue wichtige Funktion des Faltungshelfers Hsp70
Bonn, 10. Januar 2023 – Wissenschaftlerinnen und Wissenschaftler rund um Prof. Thomas Becker, Direktor des Instituts für Biochemie und Molekularbiologie am Universitätsklinikum Bonn (UKB), haben neue Erkenntnisse zur Bildung der ATP-Synthase, der Turbine der Kraftwerke der Zellen, den Mitochondrien, erlangt. Eine sogenannte „molekulare Anstandsdame”, das Protein Hsp70, übernimmt eine größere Rolle als bereits bekannt in der Reifung von Proteinen. Wie die Forschenden herausgefunden haben, fungiert das Hsp70 nicht nur als “Faltungshelfer” von Proteinen in Mitochondrien, sondern fördert den Zusammenbau der ATP-Synthase. Die neuen Ergebnisse liefern wichtige Grundlagen für das Verständnis für die Bildung der ATP-Synthase und sind nun in der renommierten Zeitschrift Nature Communication erschienen.
Der Mensch besteht bekanntlich aus vielen einzelnen Zellen. Betrachtet man jede Zelle im menschlichen Körper als eine eigene Stadt mit unterschiedlichen Gebäuden, dann ist ein Mitochondrium das Kraftwerk. Mitochondrien produzieren die zellulären Energiewährung ATP (Adenosintriphosphat), die für zellulären Funktionen unerlässlich ist. Insbesondere die Nerven- und Muskelgewebe benötigen viel Energie für ihre Funktionen. Wie in Kraftwerken üblich, braucht es darin Arbeiter und das sind im Falle der Mitochondrien Proteine, die aus dem Cytosol in das Kraftwerk importiert werden. Das Protein Hsp70 ist am Import vieler dieser Proteine in das Innere der Mitochondrien, die mitochondriale Matrix, beteiligt und katalysiert dort die Faltung der Proteine, damit sie die korrekte Form einnehmen und nicht etwa verklumpen. Viele Proteine bilden zusammen mit Partnerproteinen eine funktionelle Einheit, die Proteinkomplexe genannt werden. Die ATP-Synthase ist ein solcher Proteinkomplex, der in der Innenmembran sitzt. Die ATP-Synthase produziert den Hauptteil der zellulären Energie und kann daher als die Turbine der Kraftwerke der Zellen angesehen werden.
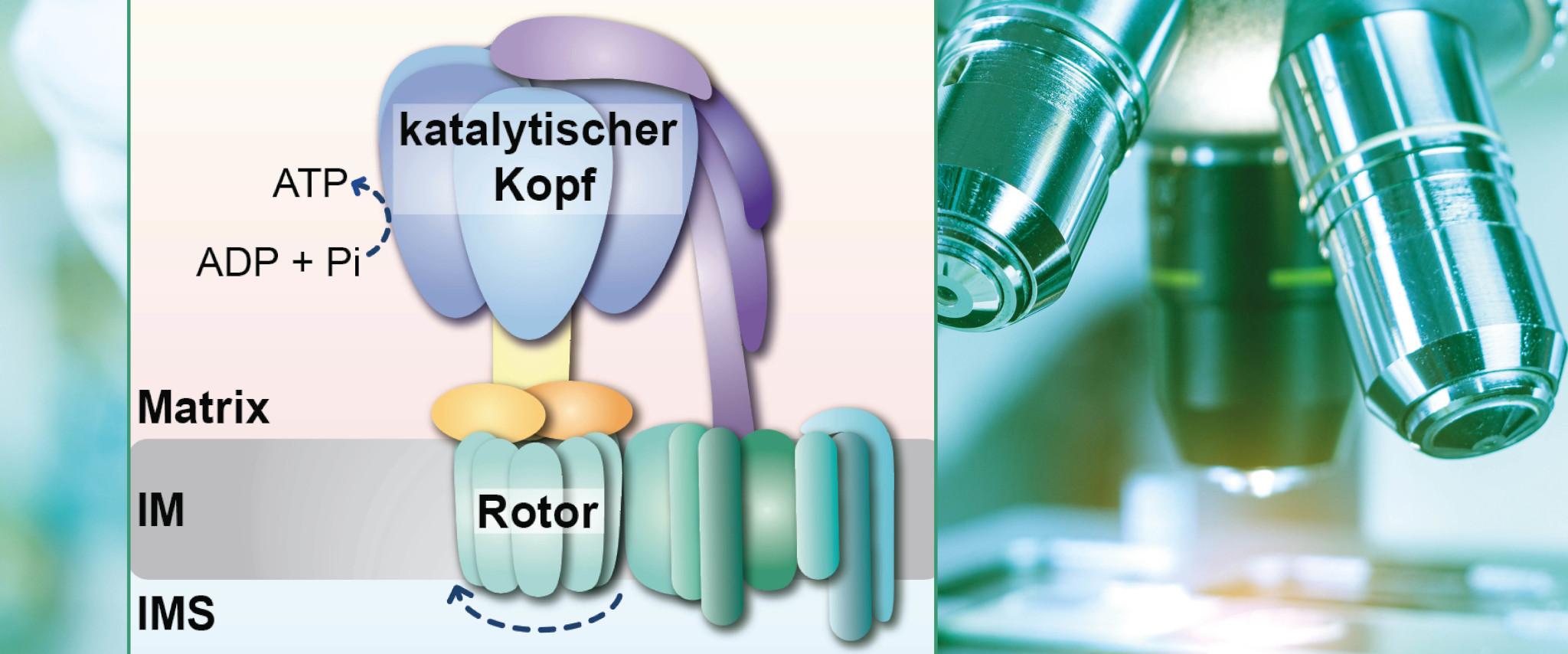
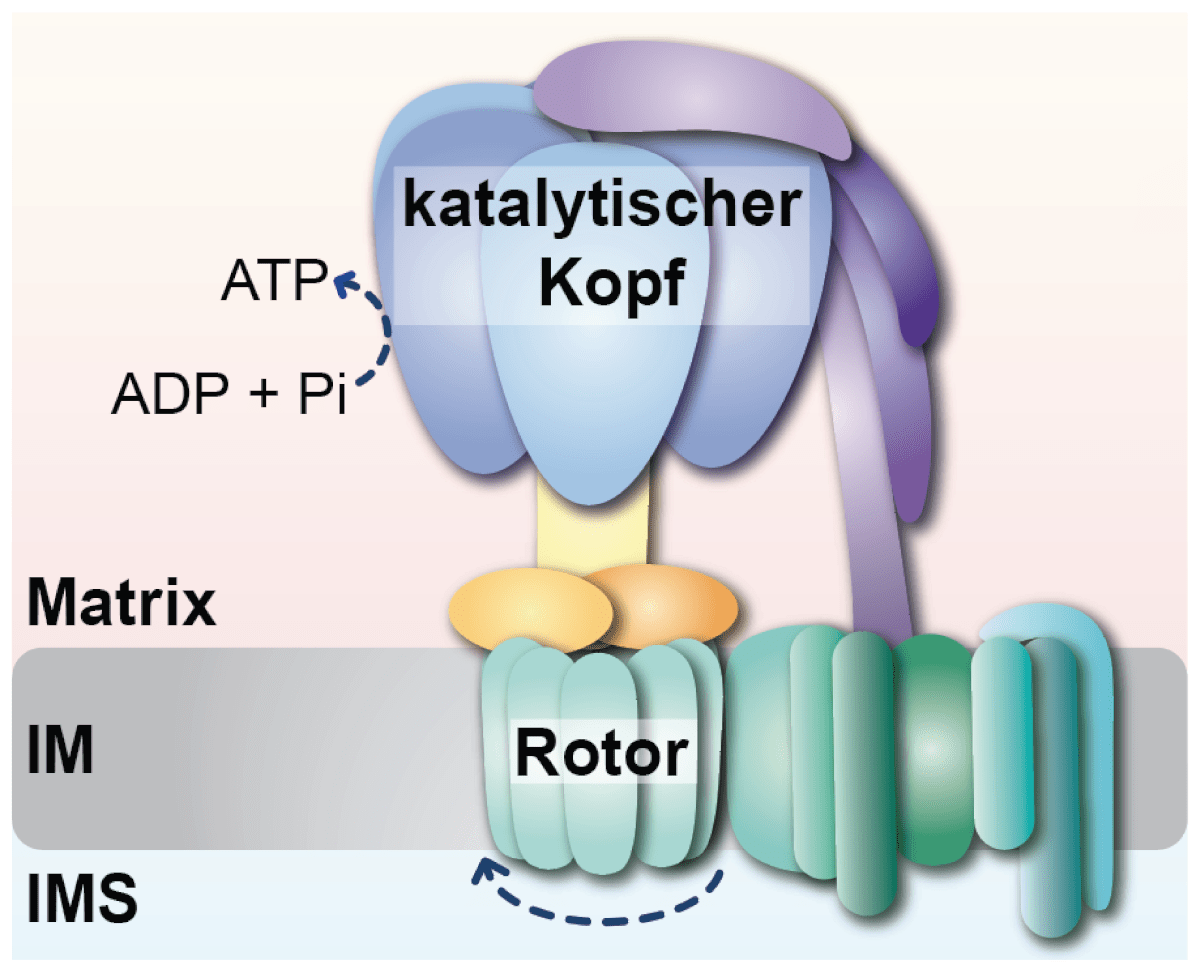
„Der Proteinkomplex ATP-Synthase besteht aus einem sich drehenden Rotor, der durch den Rücktransport von Protonen in die mitochondriale Matrix angetrieben wird. Dieser Teil ist über einen Stiel, den molekularen Stator, mit dem katalytischen Kopf des Enzyms verbunden. Die Drehung des Rotors wird auf den katalytischen Kopf übertragen, wodurch dieser ATP produziert. Wie sich der Stator und der katalytische Kopf bilden und miteinander verknüpft werden, war bislang nur teilweise verstanden“, erläutert Prof. Thomas Becker.
Die Forschungsgruppe um Prof. Thomas Becker am UKB hat nun neue Erkenntnisse dazu erlangen können. Die Wissenschaftlerinnen und Wissenschaftler haben eine weitere Funktion des Proteins Hsp70 in der Bildung der ATP-Synthase gefunden: Das Hsp70 ist nicht nur ein Faltungshelfer, sondern trägt den Forschenden zufolge auch zum Zusammenbau dieses Proteinkomplexes bei.
Dr. Jiyao Song, Post-Doktorandin in der Arbeitsgruppe von Prof. Becker, entdeckte, dass das Hsp70 mit Partnerproteinen an dem Zusammenbau des katalytischen Kopfes beteiligt ist. Zusammen mit dem Team von Herrn Dr. Dominic Winter konnte sie zeigen, dass sich Untereinheiten der ATP-Synthase an dem Hsp70 anreichern, wenn der Zusammenbau der ATP-Synthase gestört ist. Dr. Song entdeckte ferner, dass das Hsp70 die Verknüpfung des katalytischen Kopfes mit dem Stator überwacht. Somit führt das mitochondriale Hsp70 eine duale Funktion in der Bildung der ATP-Synthase aus: den Zusammenbau des katalytischen Kopfes und die kontrollierte Verknüpfung des Kopfes mit dem Stator.
Dieses Forschungsprojekt innerhalb des Sonderforschungsbereichs 1218 liefert neue Einblicke in das Funktionsspektrum von Hsp70 und in die Bildung einer zentralen Proteinmaschine für die Energiebildung in den Zellen. „Defekte in der Bildung der ATP-Synthase oder des mitochondrialen Hsp70 führen zu Erkrankungen, insbesondere des Nervensystems. Daher können die neuen Ergebnisse wichtige Beiträge für das Verständnis dieser Defekte liefern“, so Prof. Dr. Thomas Becker.
Kontakt:
Prof. Dr. Thomas Becker
Institut für Biochemie und Molekularbiologie
Medizinische Fakultät
Universität Bonn
Nußallee 11
53115 Bonn
Originalpublikation:
Song, J., Steidle, L., Steymans, I., Singh, J., Sanner, A., Böttinger, L., Winter, D. and Becker, T. (2023). The mitochondrial Hsp70 controls the assembly of the F1FO-ATP synthase. Nat. Commun. 14, 39 (2023).
https://doi.org/10.1038/s41467-022-35720-5
Bildmaterial:
Bildunterschrift: Forschende um Prof. Thomas Becker am Universitätsklinikum Bonn (UKB) haben herausgefunden, dass das mitochondriale Hsp70 eine duale Funktion in der Bildung der ATP-Synthase ausführt: den Zusammenbau des katalytischen Kopfes und die kontrollierte Verknüpfung des Kopfes mit dem Stator.
Bildnachweis: Universitätsklinikum Bonn (UKB)
Pressekontakt:
Juliana Stockheim
Stellv. Pressesprecherin am Universitätsklinikum Bonn (UKB)
Stabsstelle Kommunikation und Medien am Universitätsklinikum Bonn
Tel. +49 228 287-19891
E-Mail: juliana.stockheim@ukbonn.de
Zum Universitätsklinikum Bonn: Im UKB werden pro Jahr etwa 500.000 Patient*innen betreut, es sind 8.800 Mitarbeiter*innen beschäftigt und die Bilanzsumme beträgt 1,5 Mrd. Euro. Neben den über 3.300 Medizin- und Zahnmedizin-Studierenden werden pro Jahr weitere 580 Frauen und Männer in zahlreichen Gesundheitsberufen ausgebildet. Das UKB steht im Wissenschafts-Ranking auf Platz 1 unter den Universitätsklinika (UK) in NRW, weist den dritthöchsten Case Mix Index (Fallschweregrad) in Deutschland auf und hatte in den Corona- Jahren 2020 und 2021 als einziges der 35 deutschen Universitätsklinika einen Leistungszuwachs.
New insights into the formation of ATP synthase (Englische Version der PM als PDF)