Protein-Schredder reguliert Fettstoffwechsel im Gehirn
Studie der Universität Bonn klärt ungewöhnlichen Zusammenhang auf
Ein Protein-Schredder, der in Zellmembranen von Hirnzellen vorkommt, reguliert augenscheinlich indirekt auch den Fettstoffwechsel. Das zeigt eine aktuelle Studie der Universität Bonn. Der Schredder, die so genannte Gamma-Sekretase, gilt als möglicher Ansatzpunkt für Medikamente gegen Krebs und Alzheimer. Die Ergebnisse legen jedoch nahe, dass solche Wirkstoffe Fernwirkungen haben könnten, die es im Auge zu behalten gilt. Die Veröffentlichung ist jetzt in der Fachzeitschrift „Life Science Alliance“ erschienen.
Jede Körperzelle ist von einem Fettfilm-ähnlichen Häutchen umgeben, der Plasmamembran. In ihr schwimmen zahlreiche Proteine. Sie durchspannen die Membran von außen nach innen und dienen der Zelle unter anderem als Sensoren: Wenn sie auf der Außenseite auf bestimmte Moleküle stoßen, erzeugen sie auf der Innenseite ein Signal, das dann bestimmte Reaktionen der Zelle in Gang setzt. Andere Membranproteine sind dagegen in der Lage, bestimmte Substanzen in die Zelle zu schleusen.
Die Gamma-Sekretase übernimmt wichtige Funktionen bei der Freisetzung von membranverankerten Signalproteinen. Sie ist aber auch eine „Reinigungsfachkraft“ für ausrangierte Membranproteine: Sie zerstückelt die Eiweiße innerhalb der Zellmembran. Die Einzelteile werden dann entsorgt. Durch diese Funktion ist die Sekretase bereits vor fast zwei Jahrzehnten in den Fokus der Alzheimer-Forschung gerückt: Viele Hirnzellen enthalten nämlich in ihrer Membran ein Protein namens APP. Wenn die Gamma-Sekretase APP zerlegt, wird eines der Bruchstücke in die Gehirnflüssigkeit abgegeben: das so genannte Abeta-Peptid. Und dieses Peptid ist Hauptbestandteil der Plaques, die in den zerstörten Hirnarealen von Alzheimer-Patienten zu finden sind. „Ursprünglich hoffte man daher, durch Hemmung der Gamma-Sekretase die Alzheimer-Erkrankung bremsen zu können“, erklärt Prof. Dr. Jochen Walter. „Leider hat das bisher allerdings nicht funktioniert.“
Müll in der Membran
Heute weiß man, dass die Gamma-Sekretase für die korrekte Funktion von Zellen ausgesprochen wichtig ist. Denn wenn sie ausfällt, „vermüllt“ die Membran nach und nach. Dann können zum Beispiel bestimmte Moleküle nicht mehr so gut in die Zelle eingeschleust werden. Welche gravierenden Konsequenzen das hat, zeigt die aktuelle Studie. Auch hier spielt das APP eine Schlüsselrolle: „Wenn wir die Gamma-Sekretase in Zellkulturen hemmen, sammelt sich APP in den Membranen an“, erklärt Walters Mitarbeiter Dr. Esteban Gutierrez. „Das wiederum behindert die Aufnahme so genannter Lipoproteine aus der Umgebung.“
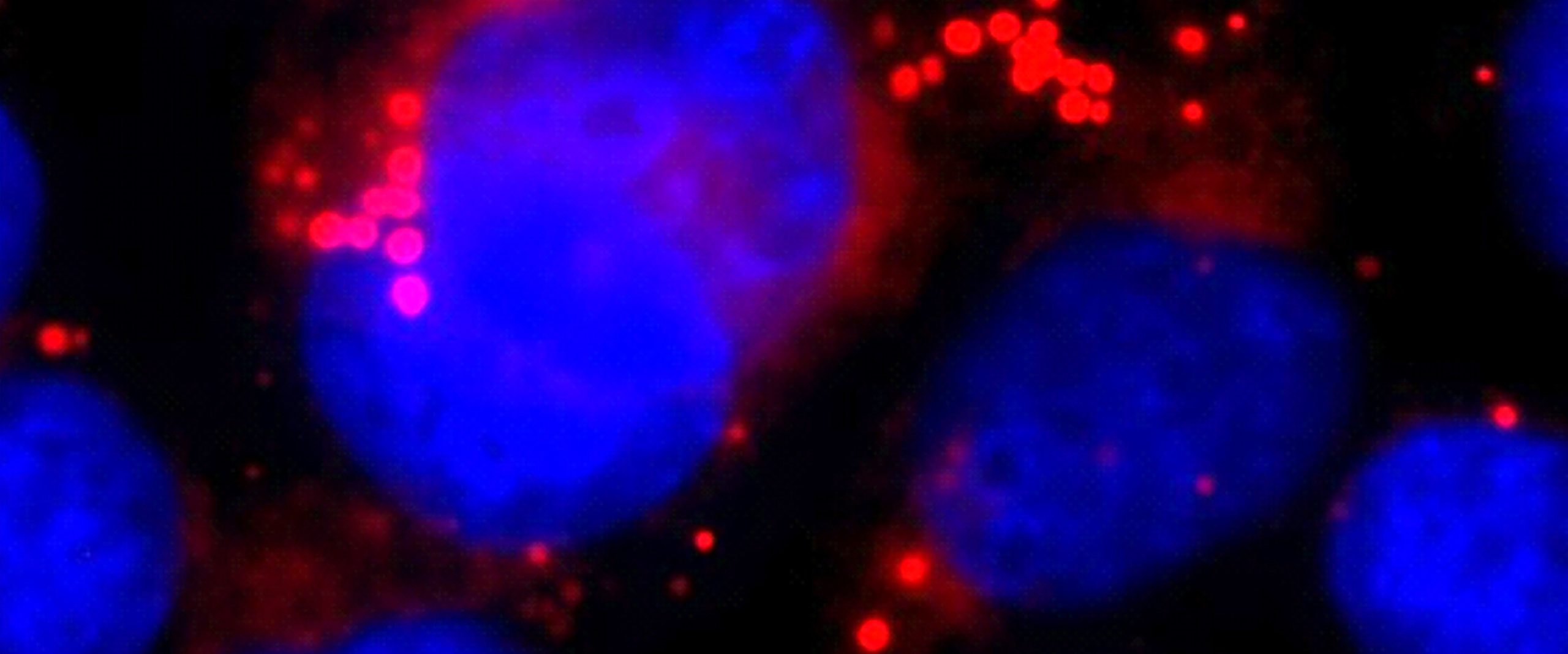
Dieser Mechanismus setzt einen fatalen Prozess in Gang. Lipoproteine sind Partikel aus Eiweißen und fettähnlichen Molekülen, den Lipiden. Wenn zu wenige von ihnen in die Zelle gelangen, vermutet diese einen Lipidmangel. Um diesen zu beheben, fährt sie die zelleigene Lipid-Synthese hoch. „Wir haben gezeigt, dass bei Hemmung der Sekretase ein zentraler Regulator der Lipid-Synthese namens LXR stark aktiviert wird“, sagt Gutierrez. Die Lipide werden zum Teil aus der Zelle transportiert; aufgrund der gestörten Lipoprotein-Aufnahme erhält die Zelle aber kein Feedback, dass diese Maßnahme erfolgreich war, und stellt weiter Lipide her. In ihr sammeln sich daher mit der Zeit zahlreiche Fett-Tröpfchen an. In zu großer Zahl führt dies regelrecht zu einer Verfettung im Zellinneren, wodurch wichtige Zellfunktionen gestört werden können.
„Andere Studien haben bereits gezeigt, dass eine Störung des Lipidstoffwechsels im Gehirn ebenfalls zur Entwicklung der Alzheimer-Erkrankung beitragen kann“, erklärt Prof. Walter. „Unsere Studie liefert Hinweise darauf, über welchen Mechanismus das geschehen kann.“ Die Hemmung der Gamma-Sekretase kann also womöglich genau den gegenteiligen Effekt bewirken, den man sich von dieser Maßnahme erhofft.
Hemmung der Sekretase behindert die Teilung von Krebszellen
Erfolgversprechender ist sie dagegen in einem anderen Zusammenhang, bei der Bekämpfung von Krebs-Erkrankungen. Es gibt in der Zellmembran nämlich Proteine, die die Zellteilung stimulieren. Wenn man in Tumorzellen die Gamma-Sekretase ausschaltet, werden diese nicht mehr aus der Membran freigesetzt und die Krebszellen können sich dann nicht mehr so schnell vermehren. „Auch in diesem Fall ruft die Behandlung Nebenwirkungen hervor“, betont Walter. „Solange sie sich hauptsächlich auf die Krebszellen beschränken, ist das vermutlich nicht weiter tragisch; dennoch sollte man sie im Auge behalten.“
Die Publikation ist auch Ausdruck einer gelungenen universitätsinternen Kooperation: In der Studie arbeiteten mit den Laboren der Professoren Jochen Walter, Dieter Lütjohann und Christoph Thiele Neurowissenschaftler, Pharmakologen und Biochemiker der Medizinischen Fakultät und der Mathematisch-Naturwissenschaftlichen Fakultät der Universität Bonn Hand in Hand.
Publikation: Esteban Gutierrez, Dieter Lütjohann, Anja Kerksiek, Marietta Fabiano, Naoto Oikawa, Lars Kuerschner, Christoph Thiele und Jochen Walter: Importance of ?-secretase in the regulation of liver X receptor and cellular lipid metabolism; Life Science Alliance; https://doi.org/10.26508/lsa.201900521
Kontakt:
Prof. Dr. Jochen Walter Klinik und Poliklinik für Neurologie Universität Bonn Tel. 0228/28719782 E-Mail: Jochen.Walter@ukbonn.de
Bild oben: Nach Hemmung der Sekretase sammeln sich in den untersuchten Hirnzellen, den Astrozyten (ihr Zellkern ist blau gefärbt), große Mengen von Lipidtröpfchen (rot) an. Diese stören die normale Zellfunktion. © AG Walter/Uni Bonn https://cams.ukb.uni-bonn.de/presse/pm-116-2020/images/Walter-Droplets.jpg